汽车上使用的蓄电池都是铅酸蓄电池,它是一种将化学能转换成电能的装置,是可逆的低压直流电源。所谓的“铅酸”是指蓄电池中极板和电解液的材料,“铅”是指极板的材料,极板又分为正极板和负极板,在正极板上是二氧化铅,在负极板上是纯铅;“酸”是指电解液的材料,它是由纯硫酸和蒸馏水按一定比例配制而成的硫酸水溶液(密度为1.24~1.31克/立方厘米),具有一定的腐蚀性。
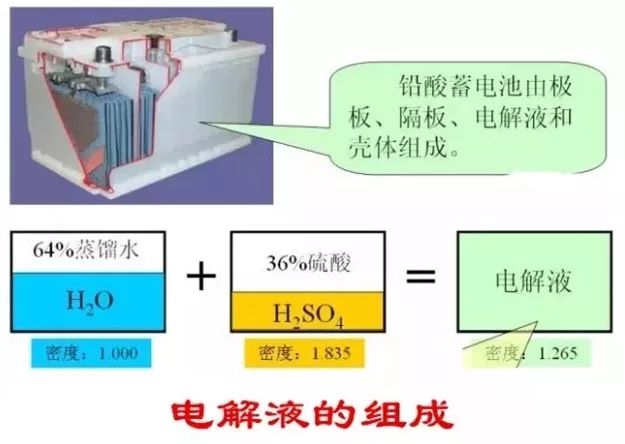
那么这些“铅”和“酸”是如何产生电能的呢?下面来看看铅酸蓄电池能够建立起电动势(电压)的原理:蓄电池在静止状态下,在正极板处,二氧化铅与硫酸作用生成带正电荷的铅离子沉浮在正极板上,使正极板具有2V的正电位;在负极板处,纯铅电离为铅离子和电子,两个电子留在负极板上,使负极板具有约-0.1V的负电位;这样在正负极之间就形成了大约2.1V的电位差,蓄电池的电动势就这样建立起来了。每一个能建立2.1V电压的正负极板组构成了一个单格电池,普通的铅酸蓄电池有六个单格电池,因此就能发出大约12.6V的电压。
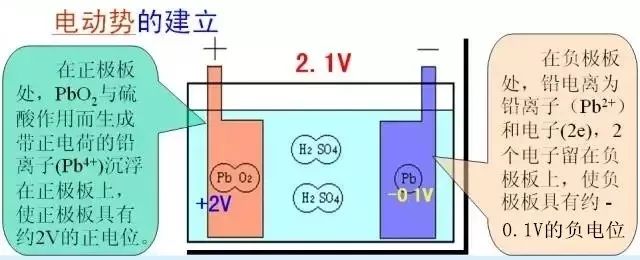
那么蓄电池在工作过程中,“铅酸”又是怎样转换的呢?
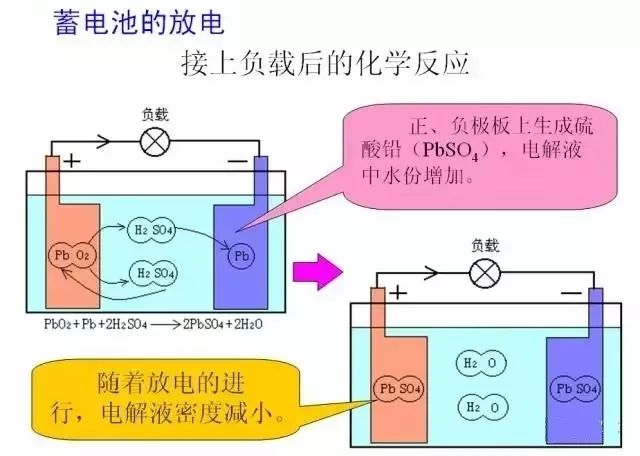
蓄电池在放电时,硫酸与正负极板上的铅和二氧化铅发生化学反应,生成了硫酸铅和水,在这个过程中有大量的电子从负极板流向正极板,从而形成了放电电流;由于电解液中水分的增加,电解液的密度是逐渐下降的,放电越多,电解液的密度越低;随着反应的进行,极板上的硫酸铅越来越多,反应的速度越来越慢,放电也就越来越少了;当极板上大部分被硫酸铅覆盖的时候,反应基本就终止了,这时候就是所说的“电放没了”,电解液的密度也下降到了最低。这个过程是蓄电池的化学能转化为电能的过程。
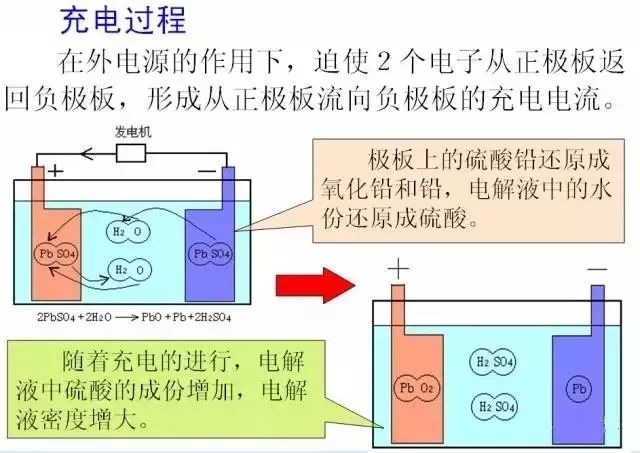
蓄电池在充电时,在外界电源的作用下,极板上的硫酸铅还原成了纯铅和二氧化铅,电解液中的水还原成硫酸,同时有大量的电子从正极板返回负极板,从而形成了充电电流;随着充电的进行,电解液中的硫酸越来越多,电解液的密度是逐渐增加的,充电越足,电解液的密度越高;但是当极板上的硫酸铅全部转化完后,电解液的密度也达到了最高,此时如果继续充电,这些电就会电解水了,生成了氢气和氧气,这就是充电过程中蓄电池里面会“冒泡”的原因。这个过程是外界的电能转化为化学能并在蓄电池中储存起来。
所以,铅酸蓄电池的充放电过程,其实就是蓄电池中硫酸与纯铅和二氧化铅的化学反应过程,在这个过程中会伴随着电解液密度的变化。因此检验电解液的密度就可以大致判断出蓄电池的充电状态,并且利用这个原理制作出了蓄电池电量指示器。而且现在的蓄电池基本都是免维护的,它可以回收反应过程中逸出的气体,并重新利用,所以这种蓄电池不需要添加电解液,也不需要补充充电,在轿车上得到广泛应用。



